Argonaute(Ago)蛋白是一类广泛存在于细菌、古菌和真核生物的保守的蛋白家族,真核生物中Ago包含四个结构域:N端结构域、PAZ结构域、MID结构域和PIWI结构域,作为RNA引导的核酸酶,在基因沉默过程中发挥重要功能。
Ago在原核中也广泛分布(prokaryotic Argonaute,即pAgo),并且表现出多样性与复杂性,然而对于pAgo的生物学功能研究有限。pAgo根据其结构域的组成,划分为长pAgo与短pAgo,其中短pAgo占pAgo的多数(60%)。短的pAgo仅具有MID结构域和PIWI结构域,并且其PIWI结构域上负责切割核酸的催化三联体发生突变。虽然人们意识到短的pAgo常与编码一些特征结构域如TIR、Sir2的基因位于相同操纵子,推测这些pAgo相关蛋白可能弥补其PIWI结构域切割核酸功能的缺失,然而对于其生物学功能一直缺乏研究。最新研究发现,短的pAgo与相关TIR和Sir2结构域蛋白与pAgo协同发挥抗噬菌体的功能,pAgo可以特异性识别外源核酸,激活TIR或Sir2的NAD+水解酶功能,从而耗竭细菌体内NAD+,导致被噬菌体感染的细菌死亡,从而发挥抵御噬菌体感染的功能。
2022年10月,来自以色列的Virginijus Siksnys团队,首先在国际知名学术期刊《Nature Microbiology》上发表了关于细菌Sir2-APAZ/pAgo(SPARSA(short prokaryotic Argonaute SIR2-APAZ system)具有抗噬菌体的功能。然而关于SPARSA是如何识别外源核酸并激活相关SIR2 NAD水解酶活性等关键问题,仍没有解答。
2024年1月11日,福建师范大学生命科学学院、南方生物医学研究中心欧阳松应团队与武汉大学龙凤教授、福州大学李金宇教授合作,在著名学术期刊《Nature Communications》在线发表了题为“Structural basis of antiphage immunity generated by a prokaryotic Argonaute-associated SPARSA system”论文。该研究通过冷冻电镜技术,结合生物化学与分子动力学模拟,揭示了SPARSA识别外源核酸并发挥抗噬菌体功能的机制。

研究首先解析了Geobacter sulfurreducens菌株的SPARSA异源二聚体的结构(3.6 Å)(图1),发现Sir2-APAZ结构域一段疏水的loop与pAgo PIWI结构域表面一个疏水区域结合,从而使APAZ与pAgo的MID和PIWI结构域共同组成一个类似原核长Ago特征性的结构,形成一个结合核酸的腔,可与引导RNA和靶DNA的结合。随后,又解析了SPARSA与引导RNA和靶DNA复合物的电镜结构(3.1 Å),分析了SPARSA特异识别核酸的分子机制。有意思的是,研究人员在SPARSA Sir2结构域催化位点H186附近均发现了未被水解的NAD+,然而,在结合核酸的结构中,研究人员发现Sir2负责NAD+水解的H186与其被水解位点距离较远(7-8 Å)。为了进一步探究SIR2 NAD+酶活性如何被激活,研究人员通过分子动力学模拟和生物化学验证,揭示靶DNA的结合引起催化位点H186所在loop向NAD+方向发生一个3 Å 的位移,使水分子进入,发挥亲核攻击发生NAD+水解。
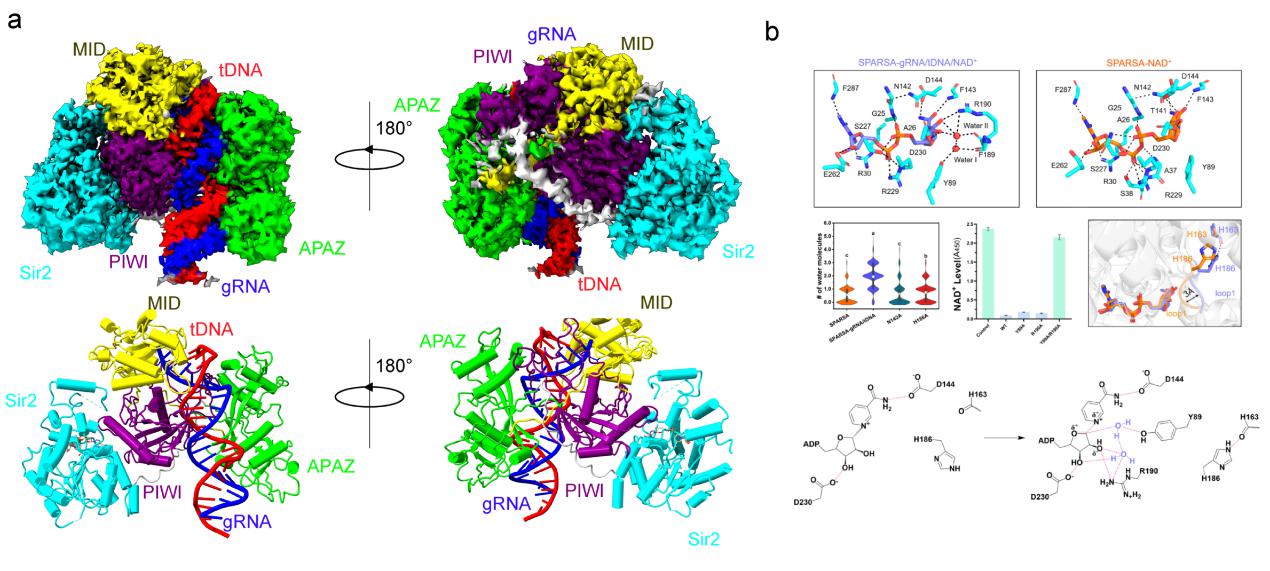
图1. a) SPARSA-gRNA/tDNA的结构; b) tDNA激活SPARSA NAD活性机制.
福建师范大学生命科学学院、南方生物医学研究中心欧阳松应教授、武汉大学药学院龙凤教授和福州大学李金宇教授为共同通讯作者。福建师范大学生命科学学院甄向凯副研究员、叶乐和黄志杰,武汉大学博士生许小龙、福州大学硕士研究生谢嵩等为共同第一作者。该工作得到国家自然科学基金和国家重点研发项目资助。
文章链接:https://doi.org/10.1038/s41467-023-44660-7