2020年4月30日,我院欧阳松应教授课题组和普渡大学罗招庆教授课题组再度合作在Advanced Science上发表了题为“Molecular basis of ubiquitination catalyzed by the bacterial transglutaminase MavC”的研究论文。这是该合作团队继2019年7月份在《Nature》、2019年底在《The EMBO J》以及2020年2月份在《J Biol Chem》上发表军团菌相关研究后的又一重要进展。

该工作解析了MavC与UBE2N-Ub的三元复合物晶体学结构(图1),MavC由Tail 结构域、Core 结构域和Insertion结构域三部分组成,UBE2N-Ub横跨在Tail 结构域和Insertion结构域之间,Core 结构域位于UBE2N-Ub的下方,起到支撑的作用。

图1 MavC-UBE2N-Ub的晶体学结构
作者发现MavC-UBE2N-Ub与MvcA-UBE2N-Ub的不仅在结构组成上高度相似(图2),而且UBE2N-Ub在MavC和MvcA中的相对位置也是相似的,活性中心均是由Cys-His-Gln构成的催化三联体。
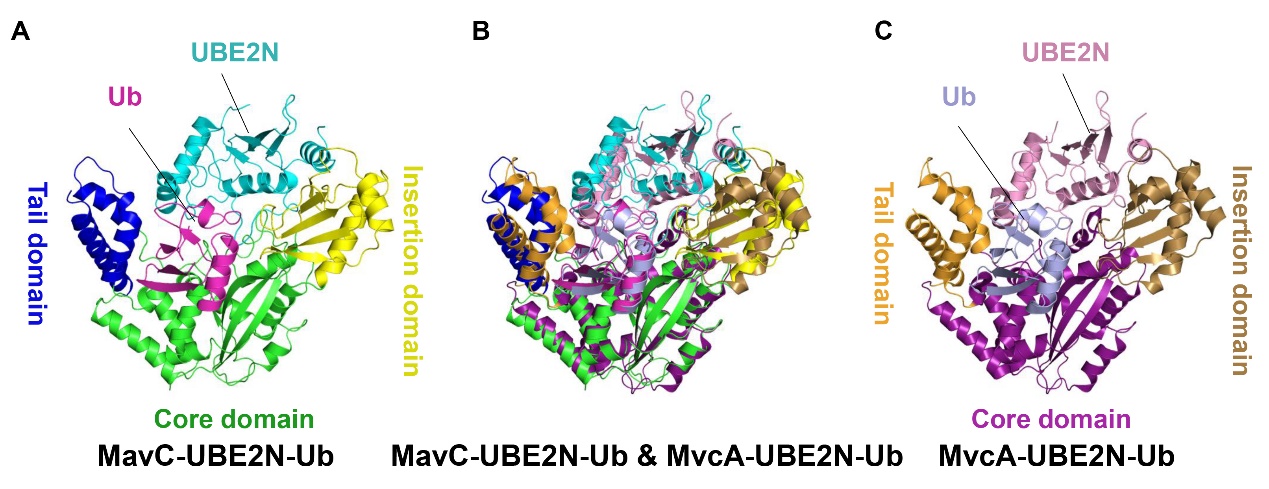
图2 MavC-UBE2N-Ub和MvcA-UBE2N-Ub的结构及其比较。
A和C分别是MavC-UBE2N-Ub和MvcA-UBE2N-Ub的晶体结构;B为MavC-UBE2N-Ub和MvcA-UBE2N-Ub的重叠比对。
然而通过MavC与MvcA一系列结构的比对分析我们发现位于催化三联体附近的MavCW255和MvcAF268是维持泛素化和去泛素化功能的关键位点,W255的疏水性小于F268,前者有利于维持K92-Q40之间异肽键的稳定,而后者不利于异肽键的稳定。与该推测相符的是这两个位点的突变导致泛素化与去泛素化活性不同程度的逆转(图3)。
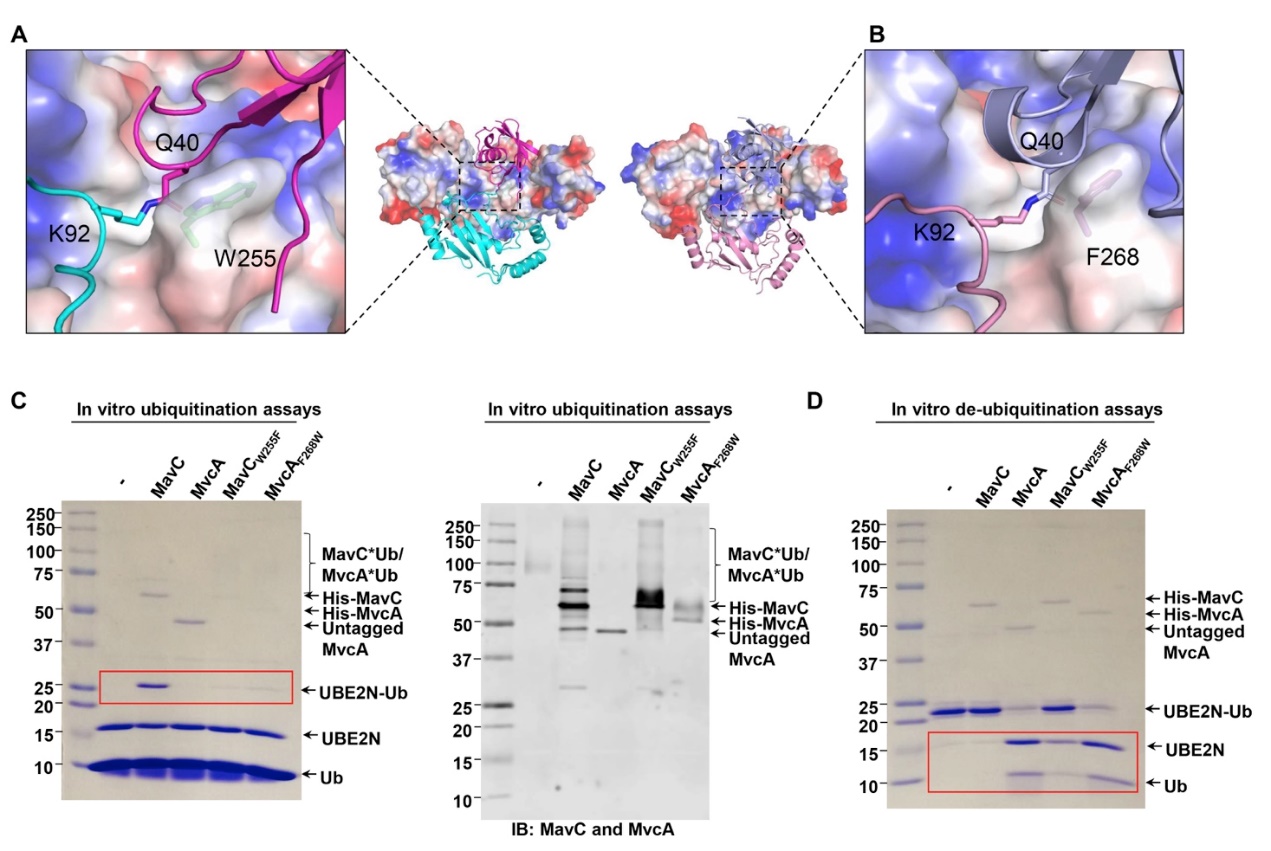
图3 MavCW255和MvcAF268是维持泛素化和去泛素化功能的关键位点。
A和B分别是MavCW255和MvcAF268在MavC-UBE2N-Ub和MvcA-UBE2N-Ub中的位置;C为突变体MavCW255F和MvcAF268W对泛素化和自身泛素化功能的影响;D为突变体MavCW255F和MvcAF268W对去泛素化功能的影响。
此外,酶与底物/产物的亲和力分析研究人员发现,MavC的Insertion 结构域与Tail 结构域的逆时针旋转使得UBE2N与Ub在空间上更易接近,Tail 结构域与Ub之间的静电引力也促进了MavC与Ub的结合,MavC与底物UBE2N和Ub的稳定结合有利于MavC催化UBE2N与Ub向异肽键合成的反应方向进行;而MvcA的Tail 结构域与MavC的Tail 结构域的旋转方向相反,呈顺时针转动,且MvcA的Insertion 结构域与UBE2N的亲和力、Tail 结构域与Ub的亲和力都低于它们在MavC中的亲和力,MvcA与产物UBE2N和Ub的低亲合力有利于催化反应向异肽键断裂的方向进行(图4)。显然,病原细菌在与宿主的长期斗争中,在最大限度节省能量的前提下,通过对酶的关键位点细微的“偷梁换柱”而衍生出复杂,精确和高效的调控机制。
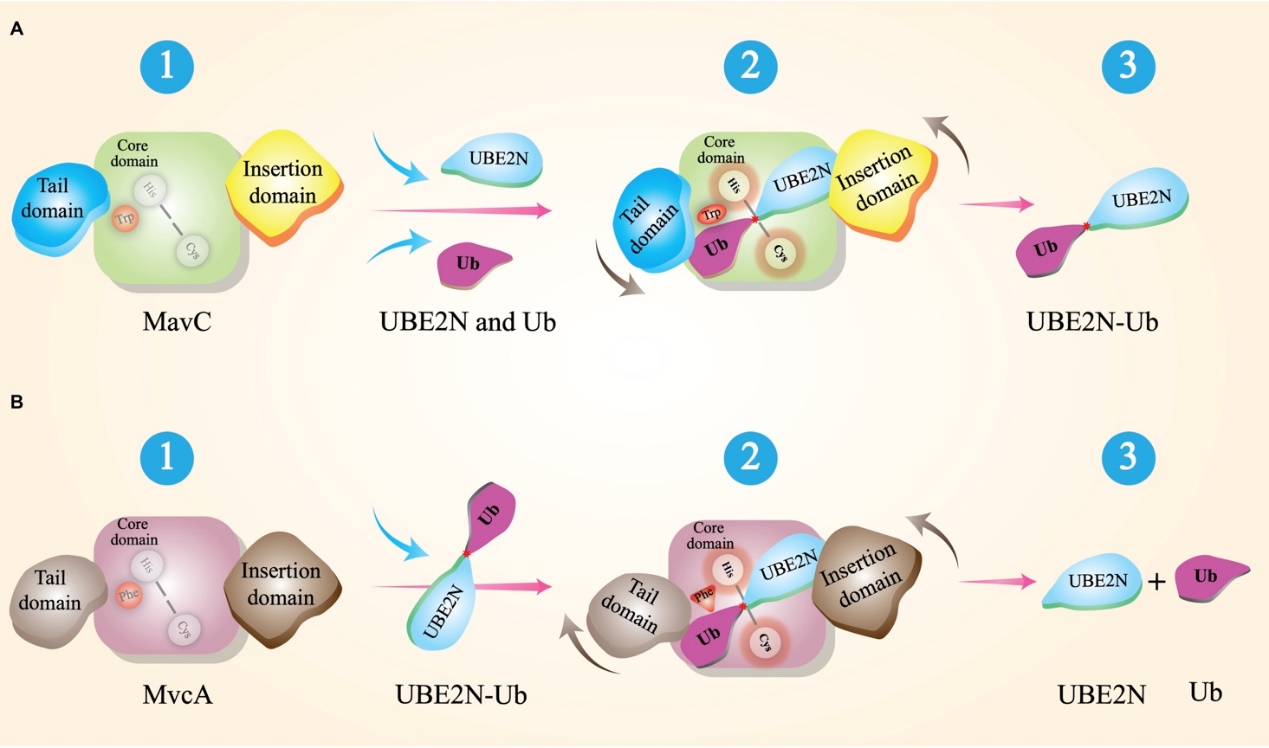
图4 MavC泛素化和MvcA去泛素化分子机制的模式图。
A为MavC催化UBE2N和Ub生成UBE2N-Ub的示意图;B为MvcA催化UBE2N-Ub被切割生成UBE2N和Ub的示意图。
欧阳松应教授课题组长期从事病原体-宿主相互作用分子机制的研究,具体包括两个方面:宿主天然免疫识别病原体的分子机制研究(包括真核宿主识别病原微生物感染的分子机制和细菌识别噬菌体感染的分子机制(CRISPR-Cas系统))、病原体逃逸宿主天然免疫反应的分子机制研究及其分子干预等。本研究对MavC-UBE2N-Ub的结构分析与体外及体内功能实验相结合多角度充分解释了为何MavC和MvcA序列和结构高度相似而泛素化的功能却相反,使人们对非经典泛素化途径的调控有了新的认识。
该文福建师范大学为第一完成单位,欧阳松应教授课题组副研究员关洪鑫、硕士研究生余婷、博士研究生王朝溪和罗招庆教授课题组付嘉琦为本文的共同第一作者,欧阳松应教授课题组研究生Vanja Perčulija和李煜也参与部分工作。本研究得到国家自然科学基金委和福建师范大学等经费支持。
全文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202000871