随着细菌耐药性问题的日益突出,新型抗生素的研制速度远远赶不上耐药菌的进化速度,特别是农业农村部规定2020年起饲料中全面禁止添加抗生素,寻找新的抗菌制剂刻不容缓。而噬菌体及其裂解酶因其高效的杀菌能力及高度的宿主专一性而成为新一代候选抗菌制剂之一。
粪肠球菌(Enterococcus faecalis,简称E.faecalis)是一种革兰氏阳性菌,又名粪链球菌,其普遍存在于人或动物肠道、口腔及生殖道内,可引起人的心内膜炎、菌血症、泌尿道感染及脑膜炎等多种疾病。在需氧革兰氏阳性菌导致的医院内感染中,其致病率仅次于葡萄球菌,在全球范围内每年由于粪肠球菌感染而导致死亡的人数高达1.7万并且还在逐年攀升。
福建师范大学生命科学学院、南方生物医学研究中心欧阳松应课题组长期从事病原体-宿主相互作用分子机制的研究,具体包括4个方面:宿主天然免疫识别病原体(包括致病菌、病毒等)分子机制、病原体逃逸宿主免疫反应分子机制、致病菌识别噬菌体感染适应性免疫分子机制(CRISPR-Cas系统)以及基于结构的抗病毒干预手段研究和基于噬菌体裂解酶的新型抗菌制剂研究等领域。
2020年3月16日,福建师范大学生命科学学院、南方生物医学研究中心欧阳松应课题组在国际知名杂志《PLOS Pathogens》上在线发表了题为“Structural and functional insights into a novel two-component endolysin encoded by a single gene in Enterococcus faecalis phage”的研究论文。该论文报道了一个独特的由单个基因编码两个蛋白组合而成的裂解酶LysIME-EF1,高效裂解致病性粪肠球菌的分子机理。

该研究表明,LysIME-EF1能够高效的裂解E.faecalis,尤其对近30株临床上引起尿道感染、败血症、化脓性腹部感染等的致病性粪肠球菌具有很高的裂解活性,具有巨大的潜在应用价值。LysIME-EF1的N端为CHAP 结构域(cysteine, histidine-dependent amidohydrolases/peptidases domain),中间为一段Linker区,C端为细胞壁结合结构域(Cell-wall binding domain, CBD)(图1A)。为阐述LysIME-EF1高效杀菌活性的分子机理,研究人员进而通过X-射线晶体衍射法确定了它的三维结构,意外的发现LysIME-EF1具有独特的三维结构:其整体结构由1分子全长的LysIME-EF1和额外的三分子CBD形成异源四聚体(动画1,图1B,1C)。研究人员通过深入分析发现在LysIME-EF1基因ORF内502-504位编码的甲硫氨酸(M168)密码子的上游有一个核糖体结合位点(Ribosomal binding site, RBS),是导致LysIME-EF1 CBD产生的原因(图2A)。随后,研究发现LysIEM-EF1独特的异源四聚体赋予其高效裂解粪肠球菌临床株的能力(图2B)。在此基础上,该研究通过流式细胞分筛技术及细菌裂解实验等方法找到了LysIME-EF1 CBD结合细胞壁的关键氨基酸(动画2)。总之,该研究首次从结构与功能角度阐明了粪肠球菌噬菌体的单个基因编码多组份裂解酶的作用机理,对多重耐药性粪肠球菌的抗菌药物开发具有重大意义。
福建师范大学生命科学学院、南方生物医学研究中心欧阳松应教授和病原体与生物安全国家重点实验室米志强副研究员为本文的通讯作者,福建师范大学为第一完成单位,欧阳松应课题组南方生物医学研究中心硕士研究生周彪、生命科学学院甄向凯副研究员、中科院上海应用物理所周欢老师以及北京化工大学研究生赵飞扬为论文的共同第一作者,课题得到了北京化工大学童贻刚教授的大力支持,武汉大学范成鹏老师,福建师范大学欧阳松应课题组研究生Vanja Perčulija也参与部分工作。本研究得到国家自然科学基金委和福建师范大学的经费支持。
动画1
动画2
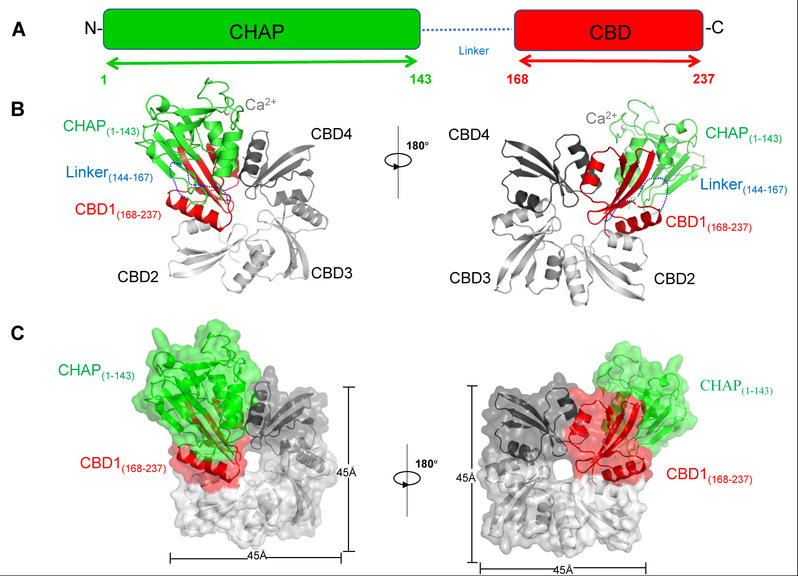
图1 LysIME-EF1的整体结构,其中N端的CHAP结构域为绿色,C端的细胞壁结合结构域(CBD)为红色,其他三个额外的CBD为不同的灰色阴影部分。
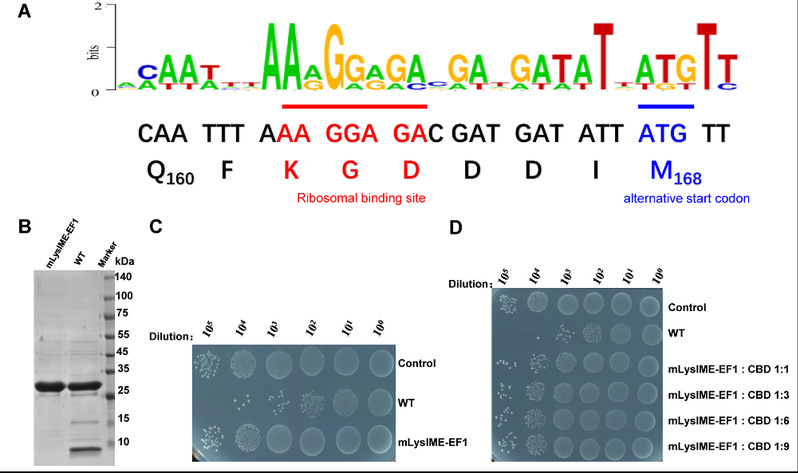
图2 LysIME-EF1的核糖体结合位点和基因内部(in-frame)的起始密码子。在LysIME-EF1的基因内部,鉴定了一个核糖体结合位点(红线下划线)和基因内部起始密码子(蓝线下划线)。核糖体结合位点和基因内部起始密码子的突变导致额外三个CBD的消失以及裂菌活性的大幅度下降。
文章链接:https://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1008394