在自然界中,细菌通常以菌群的形式存在,如土壤、人体皮肤、口腔、肠道等,不同物种间以及同物种不同基因型之间存在极为复杂的相互作用。2022年Science的一项研究表明负相互作用(拮抗)占主导地位,而互利共生(合作)则极为罕见。革兰氏阴性菌和革兰氏阳性菌分别主要通过VI型和VII型分泌系统参与接触依赖型种间/种内拮抗。在此过程中,该系统分泌的毒性效应蛋白与免疫蛋白组成E-I pair(effector–immunity pair,E-I pair),共同调控这种拮抗作用。尽管有少数几个革兰氏阳性菌E-I pair的作用机制被揭示,但总体而言,VII型分泌系统介导的种间竞争机制以及其生物学意义尚缺乏深入研究。
近日,福建师范大学生命科学学院欧阳松应课题组在Science Bulletin上发表了题为“Contact-dependent antagonism is mediated by a T7SSb toxin effector–immunity protein pair via ADP-ribosylation”的研究论文,以重要食源性肠道病原菌—单核细胞增生李斯特菌为模型,详细地揭示了其E-I pair(Ere1-Eri1)协同调控种间竞争的分子机制,为理解细菌种间拮抗作用提供了新的视角。
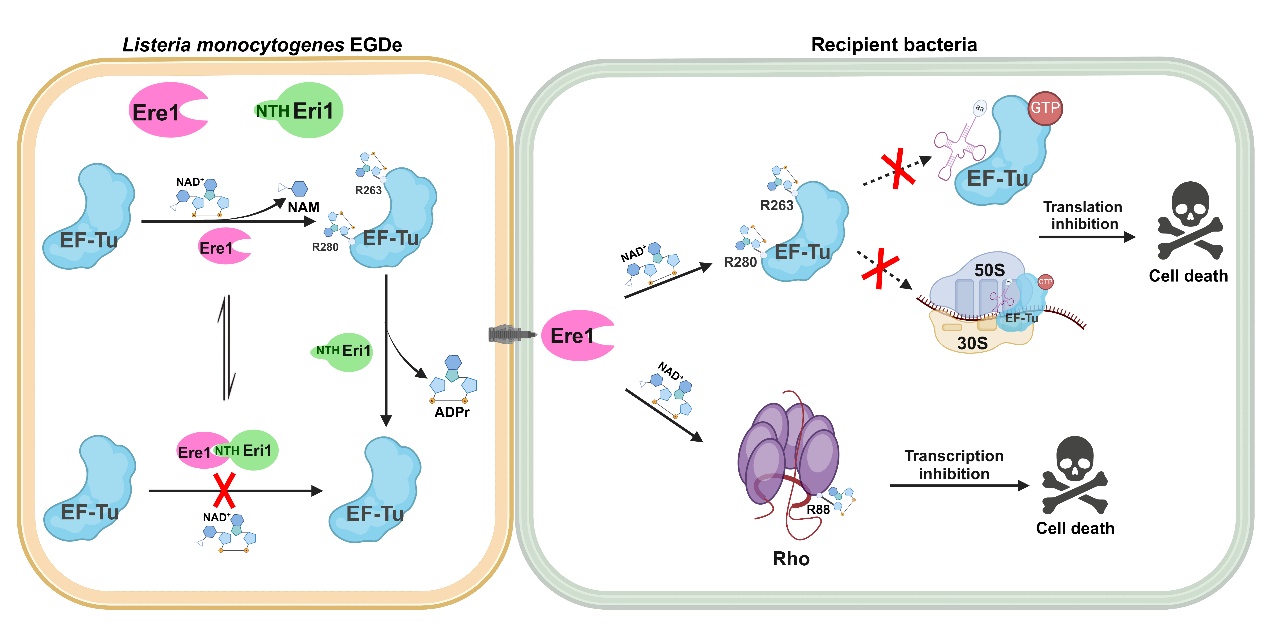
单核细胞增生李斯特菌(Listeria monocytogenes)可引发李斯特菌病,临床表现包括发热、脑膜炎、败血症等,整体死亡率高达20%-30%,免疫缺陷患者死亡率可达70%。因其高致病性、低温适应性及对特殊人群的威胁,成为食品安全和公共卫生领域的重要研究对象。基因组分析表明,单核细胞增生李斯特菌不同属、种甚至菌株分泌的毒性效应蛋白存在着显著的异质性,或许赋予了某些菌株在宿主定植和/或致病过程中的优势。目前已经预测出来超过40个效应蛋白,其中28个与免疫蛋白组成E-I pair,但是它们在单核细胞增生李斯特菌的种间竞争中作用机制及生物学意义均未被阐明。
该研究以单核增生李斯特菌EGDe 株为研究对象,鉴定到了一个新的毒性效应蛋白Lmo0066,其C端结构域具有ADP-核糖基转移酶活性,命名为Ere1。Lmo0066与免疫蛋白Lmo0067(命名为Eri1,具有ADP-核糖基水解酶活性)共同组成E-I pair。此类独特的ART-ARH型E-I pair广泛分布于革兰氏阴性菌的假单胞菌门和革兰氏阳性菌的芽孢杆菌门中。Ere1通过VII型分泌系统进入竞争细菌后,ADP-核糖基化修饰EF-Tu和Rho,抑制竞争细菌的转录和翻译过程,进而杀伤竞争细菌。作者对收集到的10株革兰氏阴性菌和14株革兰氏阳性菌进行了竞争实验,发现单核增生李斯特菌可以竞争性杀死蜡样芽孢杆菌和凝结芽孢杆菌。Ere1发挥杀菌毒性的具体机制为:一方面通过修饰EF-Tu的R263和R280,分别阻止aa-tRNA与EF-Tu结合和EF-Tu·tRNA·GTP复合物在核糖体上的装载,进而抑制蛋白质的翻译;另一方面通过修饰Rho的R88,增强Rho依赖的转录终止,扰乱蛋白质的转录调控。值得注意的是,Ere1在被分泌出去之前对单核增生李斯特菌也具有毒性,为了避免误伤自己,其免疫蛋白Eri1通过独特的双中和机制消除Ere1的毒性。Eri1的具体中和机制为:既可以通过经典的直接结合并封闭Ere1酶活中心的方式抑制其毒性;也可以通过其ADP-核糖基水解酶活性解除ADP-核糖基化修饰对底物蛋白功能的抑制而消除Ere1的毒性。
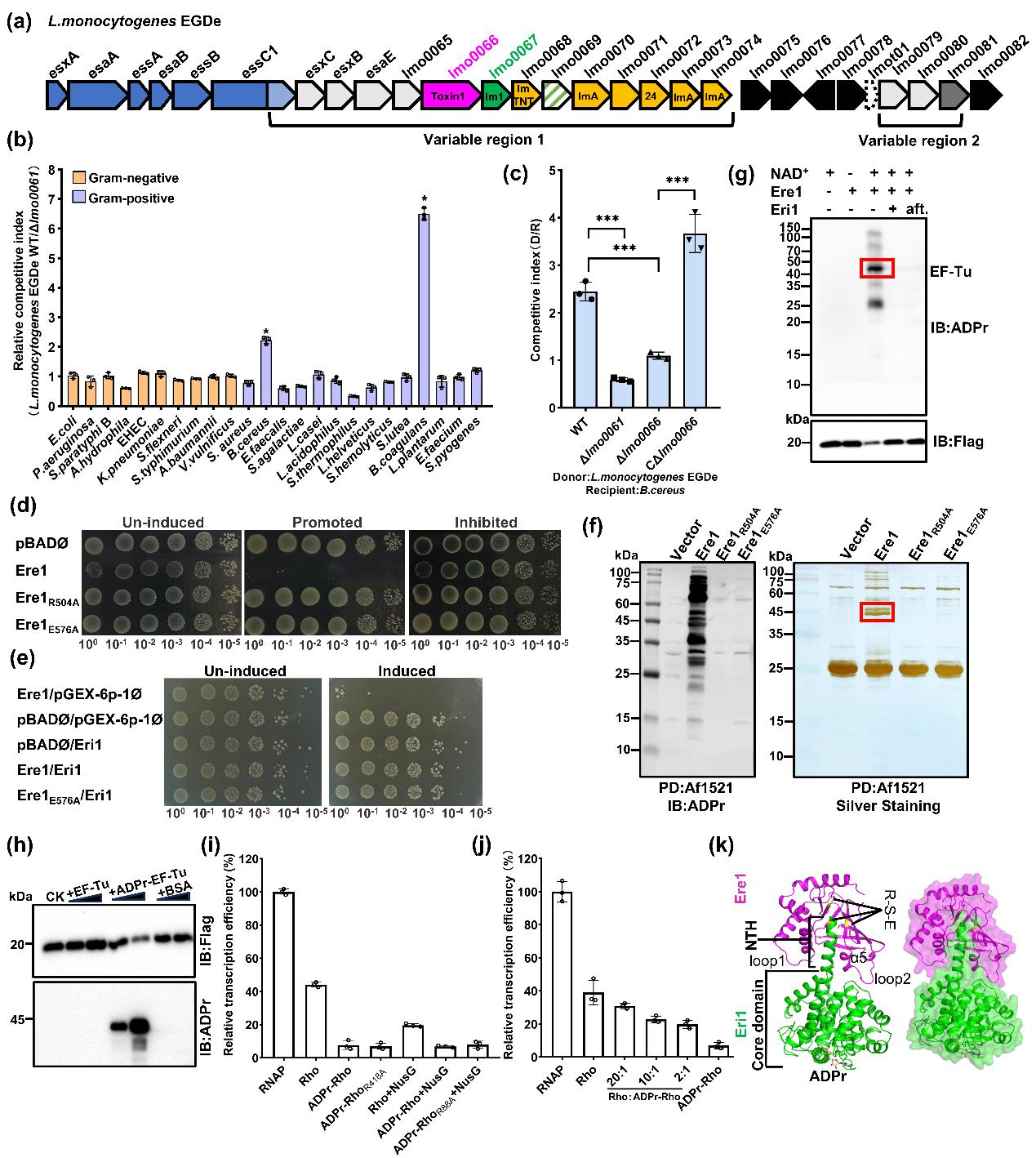
总之,该研究鉴定了一类分布广泛、作用机制独特的E-I pair,并阐明了它们协同调控单核增生李斯特菌种间竞争的详细机制,为理解革兰氏阳性菌细菌拮抗途径提供了见解。此外,深入研究细菌种间竞争机制,也可能为替代抗生素的新策略开发提供帮助,例如利用竞争性共生菌(如粪便移植中的产乳酸菌)的拮抗机制排除病原菌(如艰难梭菌)。
福建师范大学生命科学学院关洪鑫副研究员、硕士研究生吴欢为该论文的第一作者,欧阳松应教授、吉林大学付嘉琦教授和泉州第一医院郑理玲教授为该论文的共同通讯作者。该研究得到了中国科学院上海免疫与感染研究所王程远研究员团队,浙江农林大学宋厚辉、程昌勇教授团队的大力协助。该工作得到了国家自然科学基金和国家重点研发计划的支持。
全文链接:https://doi.org/10.1016/j.scib.2025.03.025