CRISPR-Cas(规律间隔成簇短回文重复序列和CRISPR相关蛋白)系统是原核生物抵御噬菌体等外来核酸的适应性免疫系统,可在RNA引导下对特定序列的核酸物质进行剪切。由于引导RNA的可编程性,CRISPR-Cas系统已被开发为基因编辑工具,在基因组编辑、核酸检测等方面具有巨大应用前景。

2025年2月12号,福建师范大学欧阳松应教授课题组在Signal Transduction and Targeted Therapy杂志(影响因子:40.8)在线发表了关于CRISPR-Cas系统第二大类效应蛋白成员Cas12h1的最新研究成果:Molecular insights and rational engineering of a compact CRISPR-Cas effector Cas12h1 with a broad-spectrum PAM。该研究报道了一个广谱、紧凑的新型效应蛋白Cas12h1的高效编辑活性,并通过解析Cas12h1-crRNA监测复合物、Cas12h1-crRNA-靶DNA干扰复合物和Cas12h1D465A-crRNA-靶DNA R-loop等复合物的冷冻电镜结构,阐明了Cas12h1加工crRNA,以及识别、切割底物的详细分子机制;进而通过理性设计,获得具有单碱基分辨率的高保真突变体Cas12hhf。该研究为开发广谱、高保真的新型基因编辑工具提供了有价值的新见解。这是该课题组继阐明CRISPR-Cas13系统(Cell Research | 欧阳松应组在CRISPR-Cas13b结构与功能方面取得重要进展;Nat Comm | 欧阳松应课题组发表CRISPR-Cas13d最新研究成果;Adv Sci综述 | 欧阳松应团队总结细菌CRISPR-Cas13系统效应蛋白结构与功能机制、应用及研究前景)、CRISPR-Cas12系统(Nat Comm | 欧阳松应组发表CRISPR-Cas12i效应蛋白结构与功能最新研究成果;NAR | 福建师范大学欧阳松应课题组揭示CRISPR-Cas12c1效应蛋白结构与功能机制;PLoS Genetics丨欧阳松应团队在CRISPR-Cas效应蛋白Cas12g切割RNA底物分子机制方面取得新进展)等效应蛋白的功能与分子机制之后,在该领域的又一研究成果。
CRISPR-Cas基因编辑技术在基础研究、临床治疗、动植物育种等多个领域均展现出良好的应用潜力。目前最为广泛使用的编辑工具是II型CRISPR-Cas系统的Cas9,然其较大体积与对原间隔序列邻近基序(PAM)的要求限制了其使用。与Cas9同属于第二大类的V型CRISPR-Cas系统(Cas12家族)为新型基因编辑工具的开发提供了备选库,目前已鉴定了10余个Cas12蛋白,然而这些Cas12蛋白主要识别富含嘧啶的5’-PAM序列,因此在实际应用中仍受一定限制。
Cas12h1属于V型CRISPR-Cas家族,其紧凑的体积(870个氨基酸)和对富含嘌呤PAM的偏好(5’-RTR-3’)提示其具有开发成新型基因编辑工具的巨大潜力,然而其酶切特征与作用机制暂不明确。该研究首次发现Cas12h1在真核细胞中具有高效编辑活性;与其他Cas效应蛋白不同,Cas12h1在细胞内仅高效切割底物的非靶标链(nontarget strand,NTS),即表现出切口酶的活性。此外,Cas12h1还具有反式切割活性,具有开发为新型核酸检测工具的潜力。
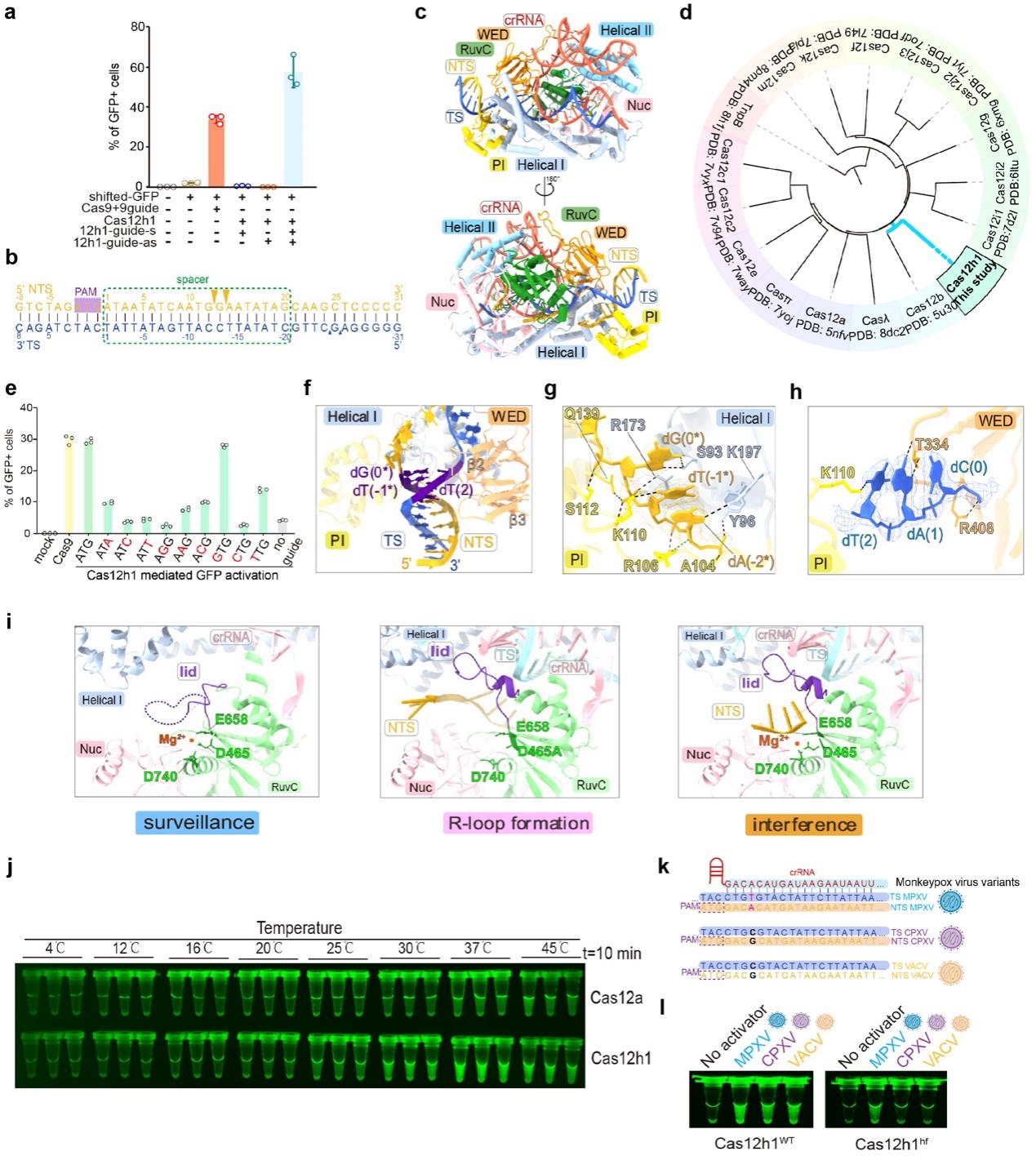
图解:新型CRISPR-Cas 效应蛋白Cas12h功能机制及其作为核酸检测潜力。a. EGFP激活实验检测Cas12h1在真核细胞内的编辑模式与效率。b. Cas12h1对底物的切割模式。Cas12h1主要切割底物中的NTS DNA。 c. Cas12h1WT-crRNA-靶DNA干扰复合物结构(卡通模式)。d. 基于Cas蛋白-crRNA-靶DNA三元复合物结构绘制的V型Cas效应蛋白进化树。e. EGFP激活实验验证Cas12h1在真核细胞内识别5’-DHR-3’ PAM序列。f. Cas12h1与底物PAM区域的相互作用。g-h. Cas12h1在PAM区域与NTS(g)和TS(h)的相互作用细节。i. 在激活过程中Cas12h1的Lid motif与NTS的构象变化。j. 不同温度下Cas12h1与Cas12a产生荧光强度比较。 k. 猴痘病毒、牛痘病毒与痘苗病毒检测靶点图示。l. Cas12h1WT与Cas12hhf的特异性比较,Cas12hhf可从正痘病毒中鉴定出仅有一个碱基差异的猴痘病毒。
为明确Cas12h1的作用机制,该研究解析了Cas12h1WT-crRNA监视复合物的结构。Cas12h1与其他V型Cas蛋白具有相似的双叶状结构,但其crRNA拥有比其他Cas12蛋白的crRNA更大的茎环结构。进而通过解析Cas12h1WT-crRNA-靶DNA干扰复合物的结构,发现Cas12h1与Cas12b具有较高的相似性,这两个蛋白在V型Cas蛋白中属于一个独特的进化分支。该研究通过体外生化实验与细胞实验证实,Cas12h1识别广谱的5’-DHR-3’序列(其中D为A、G或T,H为A、C或T,R为A或G),这拓宽了基因编辑靶点的范围。这一发现为后续开发识别广谱PAM的新型编辑工具提供了有价值的信息。该研究进一步通过解析Cas12h1D465A-crRNA-靶DNA R-loop形成复合物的结构,发现Cas12h1在激活过程中,其盖子模体(Lid motif)经历了“由灵活至稳定”的独特的激活方式。
在对Cas12h1作用机制深入研究的基础上,该研究进一步将Cas12h1开发为核酸检测工具。该研究发现与Cas12a相比,Cas12h1可在更短的时间内产生更强的信号,室温条件下10分钟内即可产生可见荧光,提示Cas12h1可以开发成无仪器依赖的快速核酸检测工具。基于增强蛋白质-核酸相互作用的策略,该研究通过理性设计,得到了高保真突变体Cas12hhf。Cas12hhf具有与野生型Cas12h1相近的检测速率,同时还具有单个碱基的分辨率,可从猴痘病毒、牛痘病毒、痘苗病毒等正痘病毒中区分出仅有一个碱基差异的猴痘病毒。总而言之,该研究挖掘出一个小型、靶点广的新型基因编辑工具Cas12h1,阐明其生化特征与分子机制,加深了对于V型Cas蛋白的认识,并开发出高保真的新型变体,扩展了基因编辑的工具库。
福建师范大学是本研究的第一完成单位,福建师范大学生命科学学院教师郑巍薇、南方生物医学中心研究生李宏宇、刘梦溪、魏宇航是本论文的共同第一作者。福建师范大学欧阳松应教授、新加坡国立大学胡纯一教授为本文共同通讯作者。该研究受到国家自然科学基金及国家重点研发计划项目资助。