近日,我院欧阳松应教授团队合作在国际著名学术期刊《Nature Communications》在线发表了题为“Mechanistic basis for the allosteric activation of NADase activity in the Sir2-HerA antiphage defense system”的论文。该研究通过生物信息学、结构生物学,结合生物化学等实验技术,揭示了Sir2-HerA系统是如何在致病菌免疫中激活并发挥抗噬菌体功能的分子机制。

在细菌、古细菌与噬菌体之间长期而激烈的生存竞争中,它们演化出了多种复杂的抗病毒系统来抵御噬菌体的侵袭。最新的研究揭示,约7%的已测序细菌基因组中存在至少一种防御系统,其中通过耗尽烟酰胺腺嘌呤二核苷酸(NAD+)来对抗噬菌体而导致的流产感染是抗噬菌体常见的策略之一,发挥水解NAD+功能的主要由含有TIR结构域和Sir2结构域的蛋白质执行。
Sir2蛋白家族是是一类广泛存在于细菌、古细菌以及高等真核生物中的保守蛋白家族。在真核生物体内,Sir2蛋白利用NAD+作为辅助因子,发挥蛋白去乙酰化酶或ADP-核糖基转移酶的功能。而在原核生物多个抗噬菌体防御系统,如欧阳松应团队此前发表的SPARSA系统(Nat Communi 10.1038/s41467-023-44660-7)和Sir2-HerA等都包含Sir2结构域蛋白。尽管最近鉴定了多种Sir2相关的抗噬菌体系统,但Sir2作为NAD+水解酶的活性如何被激活仍不清楚。在本研究中,研究人员选取了Staphylococcus aureus 菌株中Sir2-HerA系统作为研究对象,首先通过Pull-Down实验发现Sir2和HerA之间存在相互作用,并在体外实验中发现单独Sir2不具有NAD+酶活性,但在与HerA形成复合物后,Sir2蛋白的NAD+水解酶活性被激活,表现出很强的水解NAD+能力。然而,在未受到噬菌体感染时,Sir2的酶活性会受到细胞内生理浓度ATP的抑制。
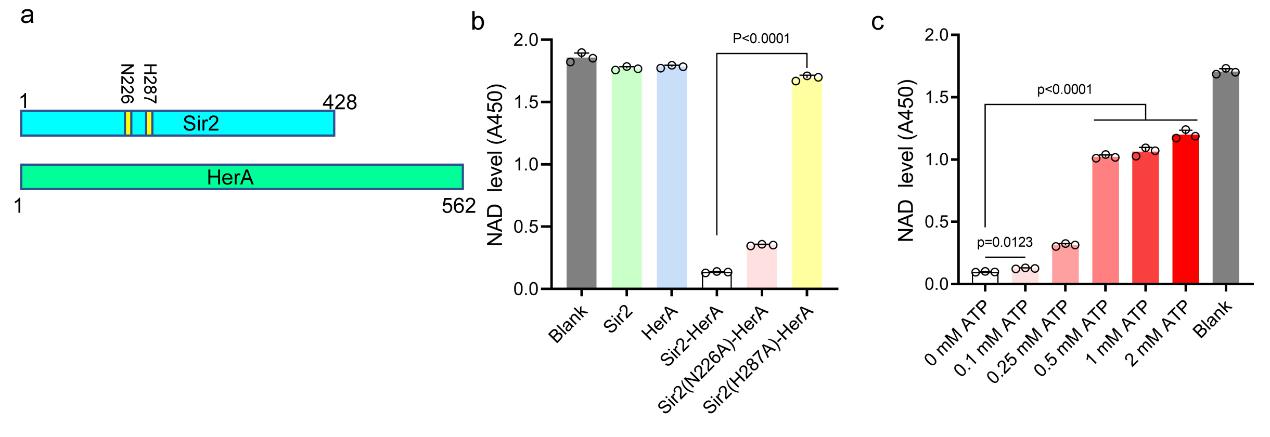
图1 HerA结合并激活Sir2的NAD+水解酶活性
为了解释HerA如何激活Sir2的NAD+水解酶活性,研究人员利用冷冻电镜技术(Cryo-EM)解析了Sir2-HerA的复合物结合ADPR的结构(分辨率为2.81Å)。该复合物是由12个 Sir2分子与6个 HerA分子组成超大复合物。通过进一步分析复合物结构,研究人员发现Sir2蛋白排列成两层六元环结构,但是仅在与HerA蛋白直接接触的Sir2六元环中观察到了NAD+的水解产物ADPR的密度,ADPR位于Sir2蛋白的小结构域和Rossmann结构域之间,这是Sir2蛋白与NAD+结合的典型位点,而在另一层六元环的Sir2分子中并未发现ADPR的存在。
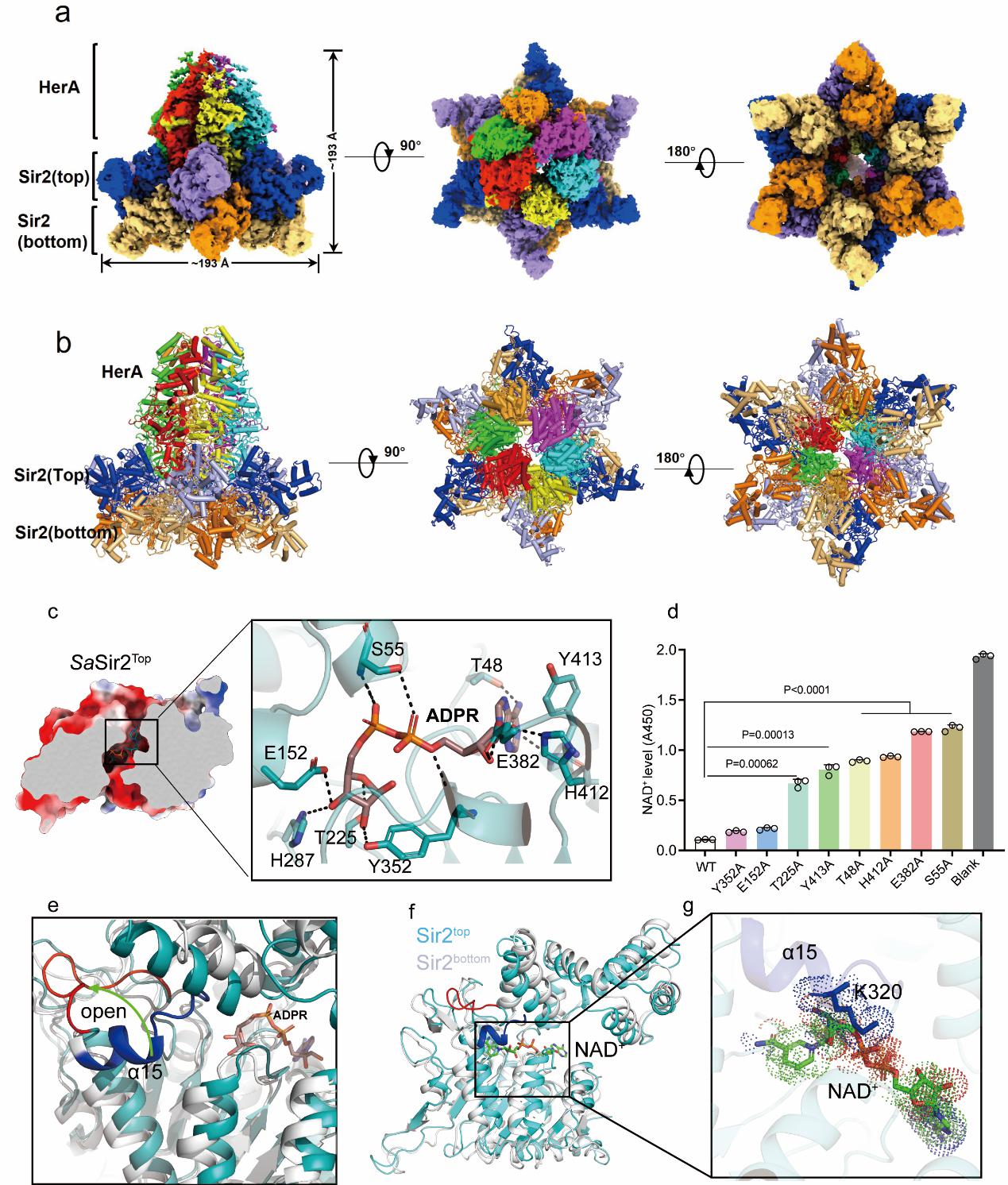
图2 Sir2-HerA的冷冻电镜结构及HerA的结合激活Sir2的结构基础
为了探究Sir2酶活的激活机制,研究人员将结合ADPR的Sir2结构与下层未结合ADPR的Sir2结构,以及通过AlphaFold预测的Sir2模型进行详细比对,结果发现与HerA直接接触的Sir2酶活位点的上方的α15螺旋变为了一个loop,并向远离ADPR的方向弯曲,这种结构变化增大了Sir2 NAD+酶活口袋。研究人员推测,这种构象变化可能使NAD+可以接近Sir2的酶活中心,从而被水解。为了验证上述猜想,研究人员利用BLI技术发现,单独的Sir2并不结合NAD+,而Sir2-HerA的突变体具有结合NAD+的能力。此外,通过删除Sir2单体的α15螺旋并进行体外NAD+酶活实验,发现截短后的Sir2蛋白单体不需要HerA的结合即可表现出NAD+酶活性,这些结果表明,α15螺旋在激活Sir2-HerA系统的激活过程中发挥了重要作用。
综上所述,研究人员提出了Sir2-HerA系统复合物组装和别构激活模型,详细解释了Sir2-HerA系统在抵御噬菌体入侵过程中的分子机制。这些发现不仅加深了对原核生物Sir2-HerA防御系统的理解,也为进一步研究微生物抗噬菌体的免疫系统提供了理论基础。
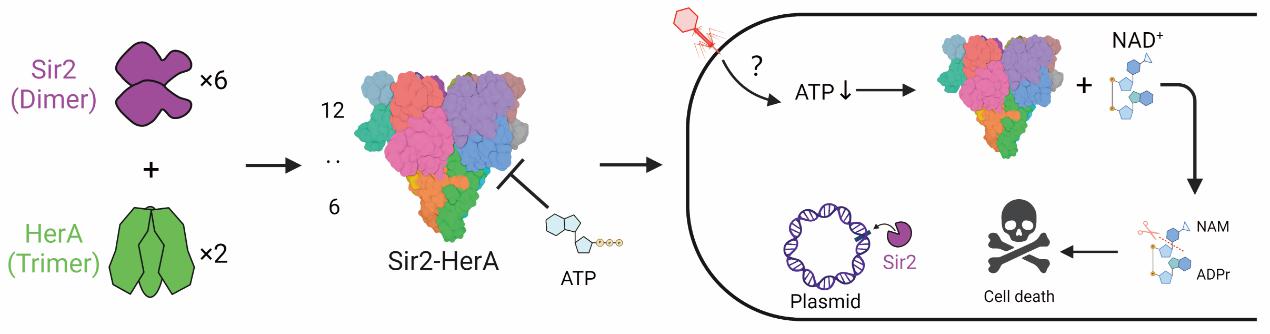
图3 Sir2-HerA抗噬菌体的分子机制总结
福建师范大学生命科学学院、南方生物医学研究中心欧阳松应教授与中国科学院广州生物医药与健康研究院的熊晓犁教授、何俊教授为本文共同通讯作者。福建师范大学生命科学学院甄向凯副研究员、刘子赫和王勖荣博士以及中国科学院广州生物医药与健康研究院周彪博士(广州国家实验室)、赵河豫博士为本文共同第一作者,该工作得到国家自然科学基金项目和国家重点研发等项目资助。
文章链接:10.1038/s41467-024-53614-6