细胞中有70%~80%的蛋白质降解是由蛋白酶体执行的,蛋白酶体普遍存在于真核生物和原核生物中,哺乳动物细胞内蛋白酶体主要以两种形式存在:20S蛋白酶体和26S蛋白酶体(即20S-19S复合体)[1]。在正常情况下,20S呈现封闭的桶状结构,蛋白水解活性位点位于桶状结构的中心,当有激活因子(Activator)结合在20S上时,20S顶端的狭窄通道被打开,底物才能进入20S的活性中心被降解。19S调节颗粒是蛋白酶体最主要的调节蛋白因子,除此之外还有11S调节蛋白家族(PA28α/β,PA28γ),PA200/Blm10等[2]。
2020年3月6日,福建师范大学生命科学学院、南方生物医学研究中心欧阳松应课题组与中科院生物物理所朱平课题组合作在《PLOS Biology》上发表了题为Cryo-EM structures of the human PA200 and PA200-20S complex reveal regulation of proteasome gate opening and two PA200 apertures的研究论文。该研究通过cryo-EM解析了人源蛋白酶体调节蛋白PA200及其与20S蛋白酶体复合物的结构,并通过HPLC-MS及其他生物化学手段发现PA200具有两个独特的孔道,以及孔道中结合的小分子,并阐明了PA200诱导20S孔道打开的分子机制。

19S调节颗粒参与由蛋白酶体介导的经典蛋白质降解途径,即ATP依赖的泛素-蛋白酶体途径。在19S的帮助下,靶蛋白被识别,经泛素化修饰,去折叠,进入蛋白酶体,被20S降解形成多个短肽,最终经进一步水解形成单个氨基酸重新用于蛋白质的合成[3]。近几年的研究表明,细胞内还存在一些不依赖于ATP和泛素修饰的蛋白质降解途径,例如PA28α/β,PA28γ和PA200等可以通过该途径调节20S的活性。20S可以与这些激活因子形成多种形式的复合物,如19S-20S-19S,19S-20S-PA200,19S-20S-PA28,PA28-20S-PA28等。
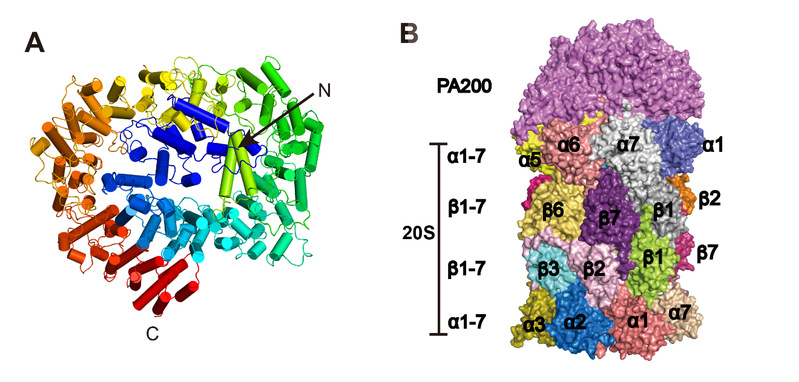
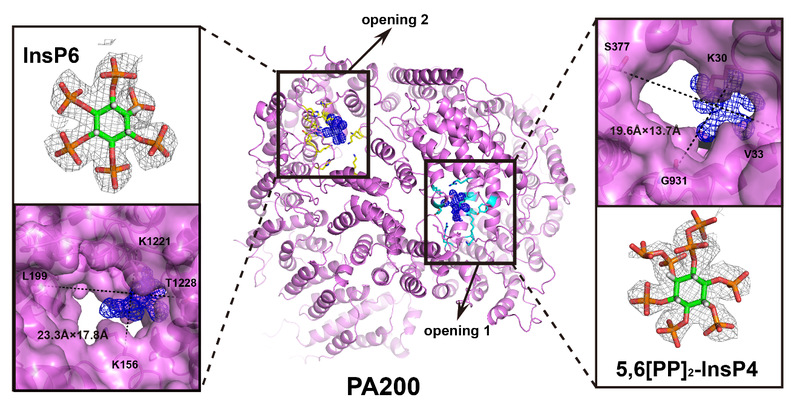
PA200是一个大小约200 kDa的单一蛋白激活因子,其在精子发生,DNA修复和线粒体遗传物质的维持中发挥重要作用[4]。然而,这么大的一个蛋白质在分子水平如何发挥功能尚不清楚,底物蛋白如何进入20S-PA200复合物的机制也不清楚。本文作者通过解析人源PA200单一蛋白结构及其与20S的复合物结构,发现PA200呈现穹顶状结构,主要由32个HEAT样重复序列组成,像“帽子”一样扣在20S上(图A)。为了分析PA200诱导底物进出20S的孔道打开机制,作者通过冷冻颗粒分选,解析了20S一端结合了PA200的复合物结构(图B)。
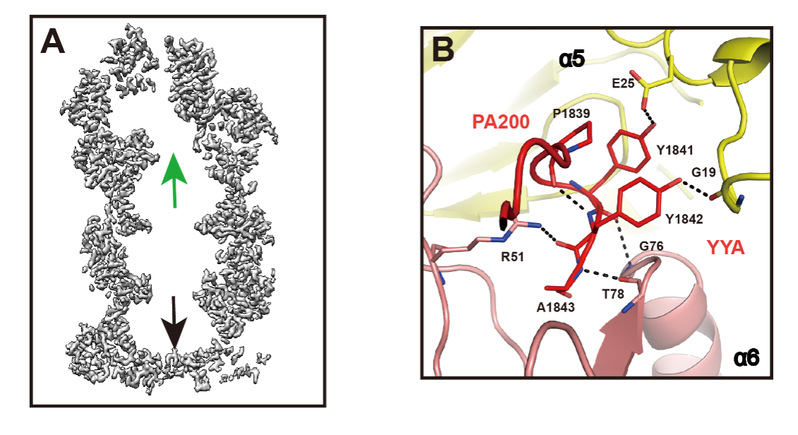
此外,作者发现20S结合了PA200的一端,孔道被诱导打开,然而没有结合PA200的一端孔道仍呈关闭状态(图A)。通过比较两端状态,发现PA200利用其C端的HbYX序列YYA(Tyr-Tyr-Ala)诱导20S的α亚基重排,使20S顶端的通道打开(图B)。
令人意外的是,作者在PA200单一蛋白和其与20S形成的复合物结构上都发现PA200有两个孔道,孔道中大量正电氨基酸结合着小分子。研究人员进一步利用HPLC-MS鉴定出孔道1结合的是5,6 [PP] 2-InsP4,而孔道2结合的是InsP6(肌醇六磷酸)(下图)。进一步与其酵母同源蛋白Blm10结构进行比较发现,Blm10上并没有这两个孔道。
PA200上的独特的BRDL区域赋予其识别乙酰化组蛋白的功能,同时有文献报道InsP6及其类似物在Ⅰ类组蛋白去乙酰化过程中发挥了重要作用,这也提示PA200结合此类物质的能力可能与BRDL识别乙酰化H4组蛋白,PA200-20S复合物降解乙酰化组蛋白之间存在某种关联,这也为后续继续揭示PA200-20S蛋白酶体识别并降解乙酰化组蛋白提供了思路。
据悉,英国剑桥分子生物学实验室(MRC Laboratory of Molecular Biology)的Paula C.A. daFonseca团队也通过cryo-EM解析了20S和PA200-20S结构,同样发现了位于PA200上的通道结合有小分子[5]。
福建师范大学生命科学学院欧阳松应课题组长期从事病原体-宿主相互作用分子机制的研究,泛素-蛋白酶体信号通路调控是一个重要方面。本研究福建师范大学生命科学学院欧阳松应教授和中科院生物物理所朱平研究员为本文通讯作者,福建师范大学为第一完成单位,欧阳松应课题组关洪鑫副研究员,南方生物医学研究中心硕士研究生余婷、黄旖旎以及生物物理研究所博士生王有望为本文共同第一作者。项目得到了国家自然基金及福建师范大学等经费资助。
全文链接:https://doi.org/10.1371/journal.pbio.3000654
参考文献:
1. Savulescu AF, Glickman MH. Proteasome activator 200: the heat is on. Mol Cell Prote
omics. 2011;10(5):R110 006890. doi: 10.1074/mcp.R110.006890. PubMedPMID: 21389
348; PubMed Central PMCID: PMCPMC3098604.
2.Jiang TX, Zhao M, Qiu XB. Substrate receptors of proteasomes. Biol Rev Camb Philos Soc. 2018;93(4):1765-77. doi: 10.1111/brv.12419. PubMed PMID: 29732666.
3.Gillette TG, Kumar B, Thompson D, Slaughter CA, DeMartino GN. Differentialroles of the COOH termini of AAA subunits of PA700 (19 S regulator) in asymmetricassembly and activation of the 26 S proteasome. J Biol Chem.2008;283(46):31813-22. doi: 10.1074/jbc.M805935200. PubMed PMID: 18796432;PubMed Central PMCID: PMCPMC2581596.
4. Ustrell V, Hoffman L, Pratt G, Rechsteiner M. PA200, a nuclear proteasome activator
involved in DNA repair. EMBO J. 2002;21(13):3516-25. doi:10.1093/emboj/cdf333. PubMed PMID: 12093752; PubMed Central PMCID:PMCPMC126083.
5.Toste Rêgo A, da Fonseca PCA. Characterization of Fully Recombinant Human20Sand 20S-PA200 ProteasomeComplexes. Molecular Cell.2019. doi:10.1016/j.molcel.2019.07.014.